La première loi de la thermodynamique nous dit que la quantité d’énergie dans l’univers est constante et ne peut être ni détruite ni créée.
L’évolution de univers Il s’agit donc d’une transformation constante de l’énergie d’une forme à une autre. Mais peu importe combien étoiles et les planètes que l’univers crée, combien de civilisations sont apparues sur ces planètes, il y aura toujours la même quantité d’énergie qu’il y avait une seconde après la Big Bang.
La transformation énergétique est ce qui fait fonctionner notre monde. Les humains et les animaux transforment l’énergie chimique de la nourriture qu’ils mangent en énergie cinétique de leur mouvement et de leur action et en énergie des processus chimiques dans leurs cellules. Les plantes vertes absorbent l’énergie du soleil et la convertir en énergie chimique sous forme d’oxygène et de sucres qui construisent vos tissus, dans un processus connu sous le nom de photosynthèse. Les centrales solaires utilisent la même lumière solaire pour produire de l’électricité. Le soleil qui nous maintient tous en vie brûle de l’hydrogène dans son noyau pour produire la lumière et la chaleur dont nous avons besoin, dissipant lentement et progressivement son énergie dans l’espace environnant.
En rapport: Ghost Energy et Dark Gravity : expliquer le côté obscur de l’univers
Histoire de la première loi de la thermodynamique.
Cependant, la première loi de la thermodynamique n’est pas née de l’étude de l’univers, mais des efforts des scientifiques des XVIIe et XVIIIe siècles pour comprendre la nature de la chaleur, selon le physicien Stephen Wolfram. Diverses idées ont émergé, notamment que la chaleur pourrait être une substance fluide ou le résultat de particules microscopiques qui composent la matière que nous voyons. Au début du 19ème siècle, les scientifiques ont conclu que la chaleur est une forme d’énergie.
A cette époque, le Machine à vapeur il s’agissait d’une nouvelle technologie en vogue, reposant sur la chaleur pour transformer l’eau en vapeur qui pouvait ensuite alimenter des engins mécaniques complexes capables de tout, de l’alimentation des locomotives à l’alimentation des équipements d’usine. De nombreux cerveaux talentueux de l’époque se sont donc posé la question de savoir comment rendre plus efficace cette technologie dépendante de la chaleur.
Le premier à jeter les bases de ce qui deviendra plus tard la première loi de la thermodynamique fut le physicien allemand Rudolf Clausius, selon Université de St Andrews. En 1850, Clausius publie un article qui le rendra célèbre. Le nom du journal est un peu compliqué : “Sur la force motrice de la chaleur et les lois de la chaleur qu’on peut en déduire”.
Dans cet article, Clausius déclare que « dans tous les cas où un travail est produit par l’action de la chaleur, une quantité de chaleur proportionnelle au travail effectué est consommée ; et inversement, par la dépense d’une quantité égale de travail, d’une quantité égale de chaleur ». quantité de chaleur produite.
La machine à vapeur et la première loi de la thermodynamique
Mais que signifie exactement la déclaration de Clausius ? Jetons un coup d’œil à la bonne vieille machine à vapeur.
Une machine à vapeur se compose d’une chambre avec un piston mobile. La chambre peut contenir de l’eau ou du gaz. Lorsque la chambre est chauffée à l’aide d’une source de chaleur externe, le gaz à l’intérieur se dilate (l’eau se transforme en vapeur), la chaleur accrue provoque une expansion supplémentaire du gaz, provoquant le déplacement du piston. Le piston à l’extérieur du moteur fait un travail utile (comme mettre les roues d’une locomotive en mouvement).
À l’inverse, l’application d’une force externe au piston peut comprimer le gaz à l’intérieur, le faisant chauffer. Dans les deux cas, la quantité de chaleur utilisée ou générée serait égale à la quantité de travail appliquée ou fournie. L’énergie totale du moteur et de son environnement restera constante.
La première loi de la thermodynamique peut être capturée par l’équation suivante : ∆U = Q — Woù ∆U est la variation de l’énergie interne, Quel est la chaleur ajoutée au système, et O est le travail effectué par le système.
L’énergie totale du système est égale à la chaleur fournie moins la quantité de travail effectuée. Le travail et la chaleur sont les processus qui ajoutent ou soustraient de l’énergie.
Thermodynamique et rôle de la chaleur.
La discipline issue des travaux de Clausius et d’autres physiciens de cette époque, dont le Britannique William Thomson (plus tard connu sous le nom de 1er baron Kelvin) et le Français Sadi Carnot, est devenue connue sous le nom de thermodynamique. La chaleur joue un rôle central dans la thermodynamique, agissant comme la force qui transforme l’énergie de sa forme brute (pensez au charbon, par exemple) en travail mécanique réel (le mouvement d’une locomotive).
La thermodynamique étudie non seulement la relation entre la chaleur et le travail mécanique, mais aussi le rôle de la température, du volume et de la pression dans l’échange d’énergie.
Un système thermodynamique a ses enthalpiequi est la somme de son énergie interne combinée aux effets de sa pression et de son volume, selon la nasa.
entropie est la mesure de la capacité du système à effectuer un travail, compte tenu de son ordre. Essentiellement, les systèmes diffèrent dans la quantité de travail qu’ils peuvent effectuer par unité d’énergie thermique en fonction de leur organisation.
L’appel Énergie libre de Helmholtz d’un système thermodynamique décrit la quantité de travail “utile” qu’un système thermodynamique fermé peut produire à température et volume constants.
Les énergie libre de gibbsd’autre part, il décrit le travail réversible maximal que peut effectuer un système thermodynamique à température et pression constantes.
Ces quatre qualités plus l’énergie sont utilisées pour décrire les propriétés de tous les systèmes thermodynamiques.
systèmes thermodynamiques
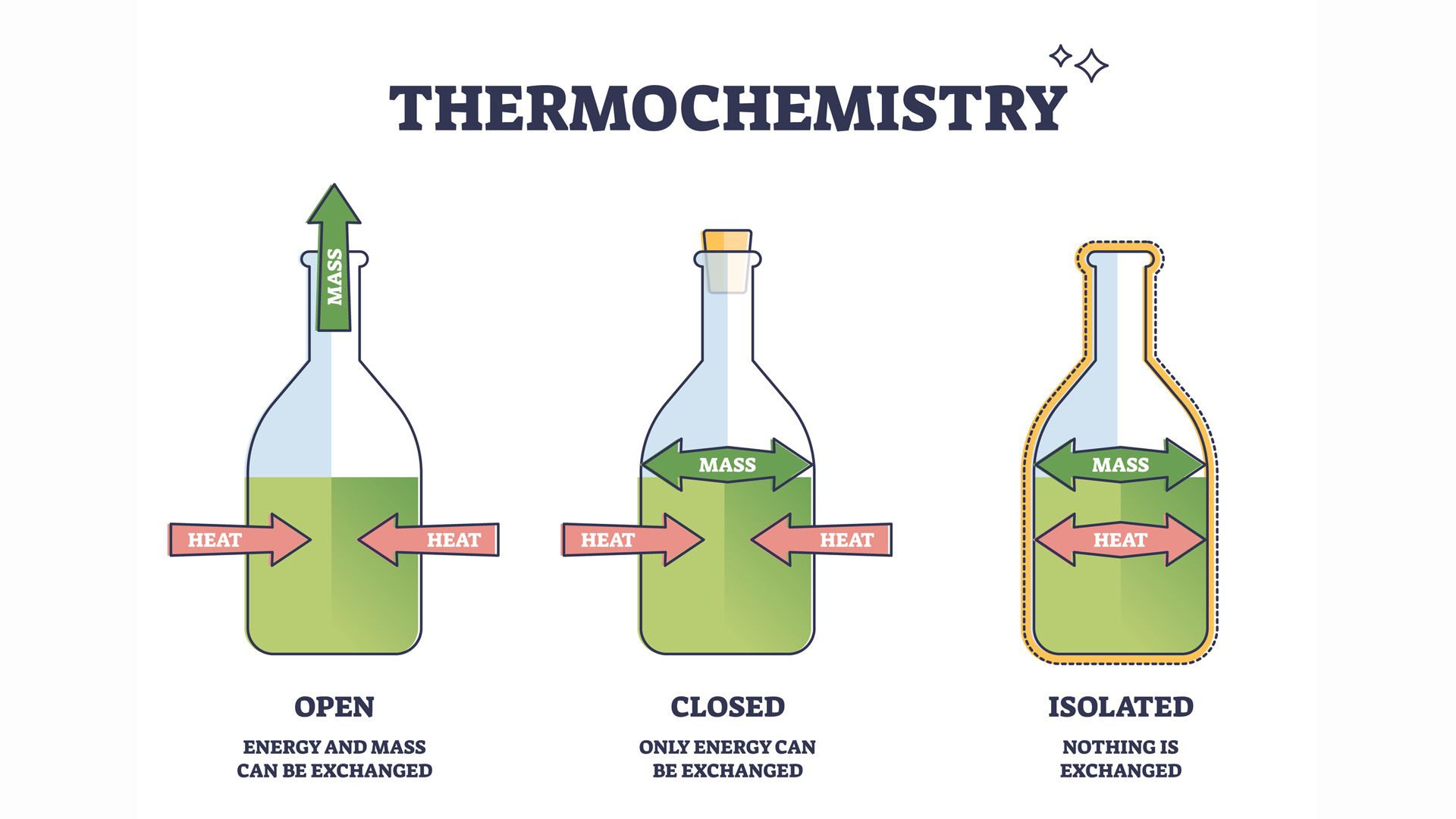
Il existe trois types de systèmes en thermodynamique : fermés, isolés et ouverts.
Les systèmes isolés n’existent essentiellement pas. Le seul système vraiment isolé est l’univers lui-même.
Les systèmes fermés visent à être aussi isolés que possible de leur environnement et n’échangent que de l’énergie, mais pas de matière, avec leur environnement. Une machine à vapeur serait un système fermé, mais une glacière thermos avec du thé ou un nain blanc étoile perdant progressivement de la chaleur dans le vide de l’espace.
Tous les organismes vivants sont des systèmes ouverts qui échangent à la fois de l’énergie (chaleur) et de la matière (nourriture, transpiration, air) avec leur environnement.
Ressources supplémentaires
En savoir plus sur la première loi de la thermodynamique sur notre site sœur sciences vivantes. Ou regarde ça vidéo drôle par l’Institution Royale. Explorez les trois lois de la thermodynamique avec le site Web éducatif apprentissage de la lumière.
Bibliographie
Smith, CW, William Thomson et la fabrication de la thermodynamique : 1840-1855, Une histoire des sciences exactes, Springer, 1977
https://www.jstor.org/stable/41133471
Hareesh, T. et al., Première loi de la thermodynamique et émergence de l’espace cosmique dans un univers non plat, Journal of Cosmology and Astroparticule Physics, décembre 2019 https://iopscience.iop.org/article/10.1088/1475-7516/2019/12/024
Zohuri, B., Première loi de la thermodynamique, Chimie physique, 2017 https://www.sciencedirect.com/topics/chemistry/first-law-of-thermodynamics
Britannica, La première loi de la thermodynamique https://www.britannica.com/science/thermodynamics/The-second-law-of-thermodynamics
Suivez Tereza Pultarova sur Twitter @TerezaPultarova. Suivez-nous sur Twitter @Spacepointcom et en Facebook.

“Introverti hardcore. Pionnier de la bière. Amoureux d’Internet. Analyste. Spécialiste de l’alimentation. Passionné de médias sociaux.”

